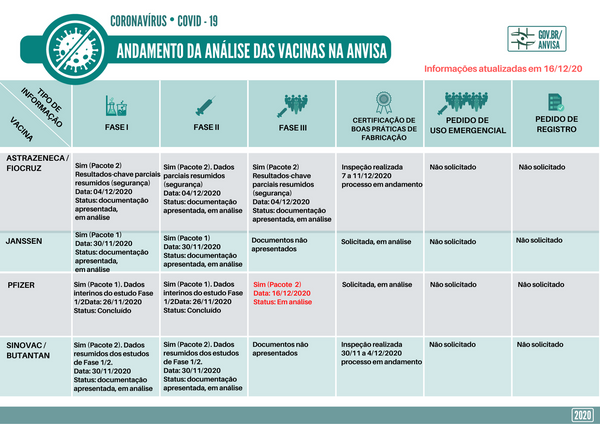
Os dados são referentes à fase 3 dos testes do possível imunizante contra o novo coronavírus.
O envio não significa que a Pfizer pediu o registro da vacina no país, mas indica que a empresa está buscando acelerar o trâmite para talvez preparar uma futura solicitação. As informações foram publicadas na plataforma da Anvisa para acompanhamento da submissão de documentos apresentados pelas empresas desenvolvedoras de vacinas.
Com a nova remessa de documentos, a empresa segue o chamado "processo de submissão contínua", onde as empresas não vão precisar ter todos os documentos reunidos para apresentá-los de uma vez só à Anvisa, como é costume com outras vacinas.
O governo federal negocia a compra de 70 milhões de doses do imunizante fabricado pela Pfizer. No Brasil, 2,9 mil voluntários participam dos testes da vacina.
Segundo a farmacêutica norte-americana, os resultados finais dos testes de sua vacina contra a COVID-19 mostraram efetividade de 95% e não foram detectados efeitos adversos importantes.
Nesta quarta-feira (16), a agência reguladora de medicamentos no Chile informou que aprovou o uso emergencial da vacina contra a COVID-19 desenvolvida pela Pfizer. Com a aprovação, o Chile tornou-se o primeiro país da América do Sul a autorizar a aplicação de uma vacina em caráter de aplicação emergencial contra a COVID-19.


