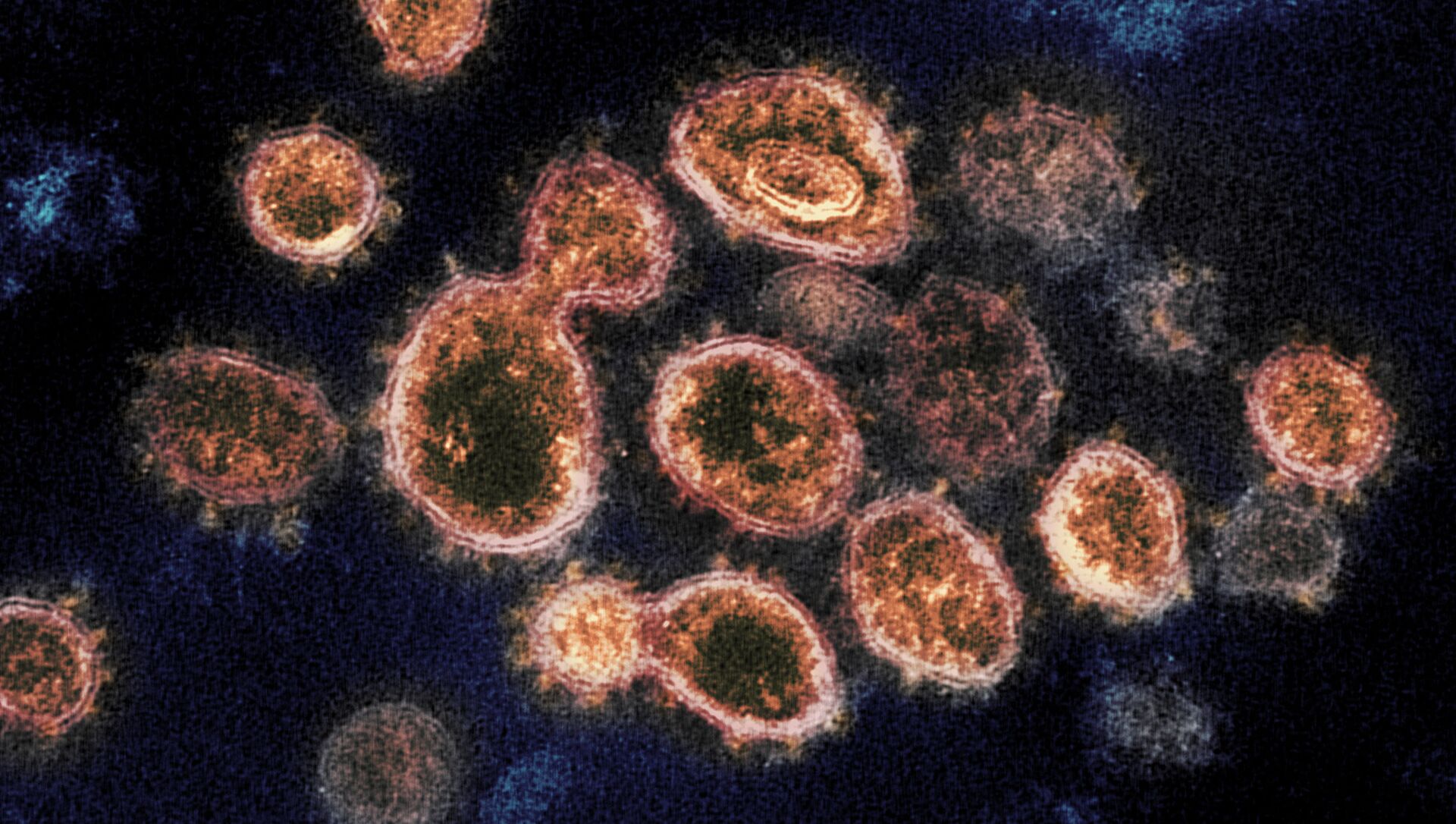
No início da pandemia, Rommie Amaro da Universidade da Califórnia, em San Diego, um químico biofísico computacional, ajudou a desenvolver uma visualização detalhada da proteína de pico SARS-CoV-2 que se liga com eficiência aos nossos receptores celulares. As descobertas foram publicadas nesta quinta-feira (19) na revista Nature Chemistry.
Agora, Amaro e seus colegas de pesquisa da Universidade da Califórnia em parceria com as Universidades de Pittsburgh, do Texas, de Columbia e de Wisconsin-Milwaukee descobriram como os glicanos, moléculas que constituem um resíduo de açúcar ao redor das bordas da proteína spike, atuam como portais de infecção.
"Essencialmente, descobrimos como o pico realmente se abre e infecta", disse Amaro. "Nós descobrimos um segredo importante do pico na forma como ele infecta as células. Sem esse portão, o vírus basicamente se torna incapaz de infecção", explica.
O pesquisador acredita que a descoberta do "portão" pela equipe abre caminhos potenciais para novas terapias para combater a infecção por SARS-CoV-2. Se os portões de glicano pudessem ser farmacologicamente bloqueados na posição fechada, o vírus seria efetivamente impedido de se abrir para entrar e infeccionar.
O revestimento de glicanos do pico ajuda a enganar o sistema imunológico humano, pois não passa de um resíduo de açúcar. As tecnologias anteriores que representavam essas estruturas eram de glicanos em posições estáticas abertas ou fechadas, o que inicialmente não atraiu muito interesse dos cientistas.
Simulações de supercomputação permitiram que os novos estudos se desenvolvessem com filmes dinâmicos que revelaram portais de glicano sendo ativados de uma posição para outra, oferecendo uma pista sem precedentes da história da infecção.
As simulações gráficas forneceram aos pesquisadores visualizações em nível atômico do domínio de ligação ao receptor da proteína spike, ou RBD, em mais de 300 perspectivas, revelando como a infecção tem acesso ao "portão" da célula hospedeira, através do receptor ACE2.
Jason McLellan, professor associado de biociências moleculares da Universidade do Texas e sua equipe criaram variantes da proteína spike e testaram para ver como a falta do portão de glicano afetava a capacidade de abertura do RBD.
"Nós mostramos que sem esta porta, o RBD da proteína spike não pode assumir a conformação necessária para infectar as células", concluiu McLellan.